REPÚBLICA BOLIVARIANA DE VENEZUELA
MINISTERIO DEL PODER POPULAR PARA LA DEFENSA
UNIVERSIDAD NACIONAL EXPERIMENTAL
POLITÉCNICA DE LA FUERZA ARMADA
NÚCLEO PORTUGUESA - EXTENSIÓN ACARIGUA
LOS LÍQUIDOS
Un líquido está formado por moléculas que están en movimiento constante y desordenado, y cada una de ellas choca miles de millones de veces en un lapso muy pequeño. Pero, las intensas fuerzas de atracción entre cada molécula, o enlaces de hidrógeno llamados dipolo-dipolo, eluden el movimiento libre, además de producir una cercanía menor que en la que existe en un gas entre sus moléculas.
Además de esto, los líquidos presentan características que los colocan entre el estado gaseoso completamente caótico y desordenado, y por otra parte al estado sólido de un liquido (congelado) se le llama ordenado. Por lo tanto podemos mencionar los tres estados del agua (liquido universal), sólido, gaseoso y liquido.
De lo cual concluimos a las siguientes características:
• Tienen volumen constante.
• Son incomprensibles.
• Tienen fuerte fricción interna que se conoce con el nombre de viscosidad.
Propiedades de los líquidos
Una vez conocidos los tipo de fuerzas intermoleculares podemos analizar y
explicar las propiedades de los líquidos:
- Capilaridad.
- Viscosidad
- Presión de vapor.
- Punto de ebullición.
- Tensión superficial.
Después de un día de lluvia o cuando has regado tu jardín, es fácil observar
imágenes como las mostradas a continuación:
Tensión
superficial
Después de un día de lluvia o cuando has regado tu jardín, es fácil observar imágenes como las mostradas a continuación:
La
tensión
superficial
Es la fuerza con que son atraídas las moléculas de la superficie de un líquido para llevarlas al interior y así disminuir el área superficial.
Es la fuerza con que son atraídas las moléculas de la superficie de un líquido para llevarlas al interior y así disminuir el área superficial.
Como
se puede observar en la imagen del lado izquierdo, una molécula en
la superficie de un líquido, es atraída hacia el interior del
mismo, debido a las fuerzas de atracción intermoleculares que
ejercen sólo las moleculas que la rodean por debajo de ella y las
que se encuentran a su alrededor en el mismo plano, por debajo de la
superficie.
A
diferencia de una molécula que se encuentra en el cuerpo del
líquido, la cual es atraída por las fuerzas intermoleculares que
ejercen todas las moléculas que la rodean, en todos los sentidos.
La capilaridad es una propiedad de los líquidos que depende de su tensión superficial. Las fuerzas entre las moléculas de un líquido se llaman fuerzas de cohesión y, aquellas entre las moléculas del líquido y las de la superficie de un sólido, se denominan fuerzas de adhesión, lo que les permite ascender por un tubo capilar (de diámetro muy pequeño).
Cuando un líquido sube por un tubo capilar, es debido a que la fuerza de cohesión es menor a la adhesión del líquido con el material del tubo. El líquido sigue subiendo hasta que la tensión superficial es equilibrada por el peso del líquido que llena el tubo. Éste es el caso del agua y, ésta propiedad es la que regula parcialmente su ascenso dentro de las plantas, sin gastar energía para vencer la gravedad.
Sin
embargo, cuando la cohesión entre las moléculas de un líquido es
más potente que la adhesión al capilar (como el caso del mercurio),
la tensión superficial hace que el líquido descienda a un nivel
inferior y su superficie es convexa.
Viscosidad
Se define como la resistencia al flujo. La viscosidad de un líquido depende de las fuerzas intermoleculares:
Se define como la resistencia al flujo. La viscosidad de un líquido depende de las fuerzas intermoleculares:
- Cuanto mayores son las fuerzas intermoleculares de un líquido, sus moléculas tienen mayor dificultad de desplazarse entre sí, por lo tanto la sustancia es más viscosa.
- Los líquidos que están formados por moléculas largas y flexibles que pueden doblarse y enredarse entre sí, son más viscosos.
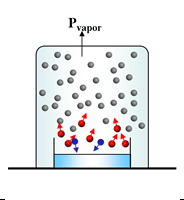
Presión
de
vapor
Sabemos
que las moléculas pueden escapar de la superficie de un
líquido, hacia la fase gaseosa, por vaporización o evaporación y además, que hay sustancias que se evaporan más rápidamente que
otras, ¿de qué depende esta diferencia?
La
explicación está en las fuerzas intermoleculares:
- si las moléculas del líquido poseen una mayor intensidad de fuerza intermolecular, entonces quedarán atrapadas en el líquido y tendrán menor faciliad para pasar a la fase gaseosa.
- por el contrario a menor intensidad de fuerza intermolecular, entonces las moléculas podrán escapar más fácilmente al estado gaseoso.
Este
análisis nos permite definir:
- volatilidad, una sustancia será más volátil cuando se evapore más fácilmente, es decir cuando posea menores fuerzas intermoleculares.
Cuando
la velocidad de las moléculas que abandonan la superficie del
líquido (evaporación) es igual a la velocidad de las moléculas que
regresan al líquido (condensación), se establece un equilibrio
dinámico. En este momento ya no se modifica la cantidad de
moléculas en el estado vapor.
El
vapor
ejerce
entonces
una
presión
constante
conocida
como
presión
de
vapor
del
líquido.
La
presión
de
vapor
de
un
líquido
depende
de
la
temperatura:
a
mayor
T,
mayor
es
la P vapor.
Punto
de
ebullición
El
punto de ebullición de un líquido es la temperatura a la cual la
presión de vapor del líquido es igual que la presión ejercida
sobre el líquido, (presión atmosférica).
Si
analizamos el gráfico de las presiones de vapor, observamos que a
diferentes condiciones de presión el líquido tendrá diferentes
puntos de ebullición.
El
valor del punto de ebullición del agua a 760 mm de Hg (1 atm), es de
100 °C, pero si la presión atmosférica es menor, entonces el punto
de ebullición será menor de 100 °C, como se puede observar en el
siguiente vídeo, realizado en Guadalajara de Buga, en el valle del
Cauca, Colombia:
Punto
Normal
de
Ebullición
El
punto normal de ebullición es la temperatura a la cual la presión
de vapor del líquido es igual a presión atmosférica de 760 mm de
Hg (1 atm).
En
el siguiente video puedes observar cómo el punto de ebullición
depende de la presión externa:
Presión de vapor
Las partículas de la superficie de un
líquido tienden a escapar si logran vencer la atracción del resto.
Algunas partículas tienen más energía cinética y velocidad que el
promedio; son éstas las que pasan al estado gaseoso. Si este
fenómeno ocurre en un recipiente cerrado, sobre el líquido se
hallan las partículas que se han evaporado y aire. Algunas
partículas de menor energía cinética tienden a volver al líquido,
es decir se condensan. Se llega entonces a un equilibrio dinámico en
el que la cantidad de partículas que se evaporan y condensan por
unidad de tiempo es la misma.
La presión de vapor es la presión del
gas en equilibrio con el líquido. Es una presión parcial ya que la
presión total está dada por el aire más el gas.
presión de vapor : presión ejercida por el vapor en equilibrio dinámico con su liquido. Es constante a T constante

cuando la velocidad de ambos procesos se igualan:
V vaporizacion = V condensacion
El liquido y el vapor se encuentran en un estado de equilibrio dinámico
presión de vapor : presión ejercida por el vapor en equilibrio dinámico con su liquido. Es constante a T constante
cuando la velocidad de ambos procesos se igualan:
V vaporizacion = V condensacion
El liquido y el vapor se encuentran en un estado de equilibrio dinámico
Evaporación
Un líquido se evapora cuando algunas de sus
moléculas, las más rápidas, debidamente orientadas en la
superficie del líquido, logran llegar a la superficie y se
escapan por el aire.
De esa forma, la intensidad de la evaporación
depende de varios factores, como son:
La
influencia
de
la
naturaleza
del
líquido
Si colocamos cinco gotas de éter común en un vaso
y cinco gotas de agua en otro, será posible observar que el éter se
evaporará con mayor rapidez que el agua.
La rapidez de evaporación de substancias, como el
éter, depende de las fuerzas que unen sus moléculas. Por eso, un
líquido con moléculas débilmente enlazadas se evaporará más
fácilmente que otro en igualdad de condiciones. Es como si algunos
líquidos “resistiesen” más a la separación de sus moléculas
debido a la fuerza de atracción intramolecular existente. Un ejemplo
de esa fuerza es el famoso “puente de hidrógeno”, un enlace
considerado fuerte que ocurre entre el hidrógeno y un elemento muy
electronegativo (Flúor, oxígeno y Nitrógeno por ejemplo) que está
presente en uno de los principales componentes de nuestro cuerpo, el
agua.
Temperatura
Cuanto mayor la temperatura, mayor la energía
cinética media de las moléculas. Eso significa que más rápidas
son las moléculas del líquido haciendo más intensa la evaporación.
En general, cualquier líquido evapora a cualquier temperatura.
Superficie de
contacto
Cuanto mayor el área del líquido expuesto al aire
o vapor, más rápida será la evaporación pues más moléculas
estarán pasando al estado de vapor. No confundir “área” del
líquido con el “volumen” del líquido en evaporación.
Considerando recipientes con el mismo volumen de un líquido,
evaporará más rápidamente el recipiente que propicie una mayor
área de contacto con el aire.
Presión existente
La presión tiene un valor determinante en el
proceso de vaporización de un líquido. Ella actúa como un agente
facilitador o un obstáculo en el pasaje de las moléculas más
rápidas y orientadas de la superficie del líquido que promueven el
proceso de transición entre la forma líquida y la forma de vapor.
Por lo tanto, cuanto mayor la presión, más difícilmente las
moléculas con potencial para que salgan del estado líquido y pasen
a la forma de vapor logren tal hazaña.
solo las partículas que se encuentren en la superficie del liquido escapan de la atracción de las demás partículas
-deben adquirir suficiente energía para liberarse
-El proceso ocurre lentamente a cualquier T.
Ebullición
Al revés de la evaporación, la ebullición sólo
ocurre en una cierta temperatura, llamada temperatura (o punto) de
ebullición.
El punto de ebullición depende de dos factores
fundamentales:
Naturaleza del
líquido
Cuanto más débil es la unión entre las moléculas,
más bajo será el ponto de ebullición ya que menos energía será
necesaria para separar las moléculas unas de las otras.
Presión ejercida
sobre el
líquido
En regiones altas, la presión atmosférica es
menor que al nivel del mar; debido a la disminución de la capa
de aire sobre dicho lugar. Por ello los líquidos
entran en ebullición
más fácilmente en
grandes alturas. Cuanto mayor la
altura, menor será la temperatura de ebullición y menor será la
presión existente.
En general, a cada quilómetro sobre el nivel
del mar, la temperatura de ebullición disminuye 3°C.
Por lo tanto, si a una determinada altura el agua
hierve a 66°C tendremos 34/3 = 11km, o sea, en lo alto de una
montaña de 11km de altura; el Everest mide 8,5 Km. luego
8,5×3 = 25,5; 100-25,5= 74,5°C (esa es aproximadamente la
temperatura en que hierve el agua en lo alto del Everest)
Sabemos que la temperatura es importante hasta en el
simple hecho de preparar un té. Por eso, aunque el agua hierva más
fácilmente el lo alto de una montaña, hay un aspecto negativo en
esa cuestión: cocinar alimentos en recipientes abiertos es mucho más
difícil, además que el té o café calentado a esa temperatura no
tienen el mismo gusto.
Por lo tanto, cocinar porotos en una olla abierta en
lo alto de una montaña, por ejemplo, será un proceso
más lento do que si
cocinásemos a nivel del mar.
esta imagen representa una temperatura determinada. (T)
la vaporización se produce en todo el volumen del liquido y no solo en la superficie. cualquier partícula, del interior o de la superficie, adquiere suficiente energía para escapar de sus vecinas ( la energía es proporcionada por una fuente calórica).
La
destilación
Es
el
proceso
que
se
utiliza
para
llevar
a
cabo
la
separación
de
diferentes
líquidos,
o
sólidos
que
se
encuentren
disueltos
en
líquidos,
o
incluso
gases
de
una
mezcla,
gracias
al
aprovechamiento
de
los
diversos puntos de ebullición
de
cada
sustancia
partícipe,
mediante
la vaporación
y
la condensación
Los
puntos
de
ebullición
de
las
sustancias
son
una
propiedad
de
tipo intensiva, lo
que
significa
que
no
cambia
en
función
de
la
masa
o
el
volumen
de
las
sustancias,
aunque
sí
de
la
presión.
Existen
diferentes
tipos
de
destilación:
- Destilación simple
- Destilación fraccionada
- Destilación al vacío
- Destilación azeotrópica
- Destilación por el arrastre de vapor
- Destilación mejorada
Destilación simple:Para destilar se utiliza un aparato llamado alambique. Dicho alambique está formado por un recipiente en el cual se colocará la mezcla a la cual se le aplicará una fuente de calor. Seguidamente encontraremos un condensador, donde se producirá el enfriamiento de los vapores que hayan sido generados, haciéndolos pasar de nuevo a estado líquido para ser recogidos de nuevo en otro recipiente, donde el líquido se encontrará concentrado.
La destilación se utiliza en la industria química para poder separar mezclas, ya sean éstas simples o complejas. Las diferentes destilaciones simples se pueden dividir en continuas y discontinuas.Un aparato básico de destilación simple, consta de las siguientes partes:
- Matraz redondo, que sirve para contener la mezcla, así como también porcelana porosa, para evitar el sobrecalentamiento, y que se caliente de manera homogénea.
- Cabeza de destilación.
- Una entrada de agua, por la parte inferior del tubo refrigerante, el cual siempre debe permanecer lleno de agua.
- Salida de agua, que suele estar conectado en la parte inferior del tubo.
- Bomba de vacío, aunque no suele ser necesario si realizamos
la destilación a presión atmosférica.
Destilación
fraccionada:
Es una variante de la destilación simple usada generalmente para
realizar la separación de líquidos que posean puntos de ebullición
con valores cercanos.
Se diferencia de la destilación simple sobretodo en que éste tipo utiliza una columna de fraccionamiento, lo que permite que los vapores tengan más contacto entre ellos, subiendo junto al líquido condensado. Este proceso hace más fácil la tarea de intercambiar el calor entre los vapores, así como los líquidos. Dicho intercambio provoca también un intercambio de masa, de donde los líquidos, que tienen menor su punto de ebullición, pasando a vapor, y los vapores, con un punto de ebullición más alto, pasan a estado líquido.
Se diferencia de la destilación simple sobretodo en que éste tipo utiliza una columna de fraccionamiento, lo que permite que los vapores tengan más contacto entre ellos, subiendo junto al líquido condensado. Este proceso hace más fácil la tarea de intercambiar el calor entre los vapores, así como los líquidos. Dicho intercambio provoca también un intercambio de masa, de donde los líquidos, que tienen menor su punto de ebullición, pasando a vapor, y los vapores, con un punto de ebullición más alto, pasan a estado líquido.
Destilación al
vacío:
Este tipo de destilación es una operación que complementa la
destilación del crudo que se destila a presión atmosférica, y que
no es vaporizado, saliendo por la parte baja de la columna de
destilación.
En la destilación al vacío se consiguen tres productos
diferentes:
– Gas Oil ligero (GOL)
– Gas Oil pesado (GOP)
– Residuo de vacío
– Gas Oil ligero (GOL)
– Gas Oil pesado (GOP)
– Residuo de vacío
Destilación azeotrópica:
Este tipo de destilación es una técnica que se utiliza para
romper un azeótropo en las destilaciones. Un
azeótropo es una mezcla en estado líquido de varios componentes que
tienen un punto de ebullición constante, y de dicha manera, cuando
la mezcla pasa a estado gaseoso (vapor), sus componentes se forman
como si fuesen el mismo.
Destilación
por arrastre
de vapor:
Es una destilación que se realiza por arrastre del vapor de agua,
a partir de la vaporización del componente de la mezcla, que sean o
no, volatiles.
El proceso se realiza inyectando agua ( vapor) en el interior de la
mezcla, pasando a llamarse “ vapor
de arrastre”,
aunque el nombre no es del todo real, pues su función no es
arrastrar, sino condensarse, consiguiendo formarse otra fase.
Destilación mejorada:
Cuando una mezcla está formada por varios compuestos con puntos de ebullición similares, se debe tener en cuenta otras formas menos económicas que la destilación normal.
Equilibrio
vapor-líquido
Las
consideraciones
teóricas
para
el
estudio
de
la
destilación
son
el
equilibrio
entre
las
fases
de
vapor
y
líquidos
en
el
sistema
que
está
sometido
a
esta
operación
unitaria.
De
acuerdo
con
la
teoría
cinética,
hay
un
continuo
paso
de
moléculas
de
la
superficie
del
líquido
al
espacio
libre
que
se
encuentra
sobre
él.
Al
mismo
tiempo
moléculas
de
vapor
regresan
a
la
superficie
del
líquido
a
una
rata
que
depende
de
la
concentración
del
vapor.
A
medida
que
la
concentración
de
moléculas
de
vapor
se
incrementa,
se
va
estableciendo
una
condición
de
equilibrio
entre
el
líquido
y
el
vapor
y
se
llega
a
él
cuando
la
rata
de
evaporación
es
exactamente
igual
a
la
rata
de
condensación.
La
presión
ejercida
por
la
fase
vapor
en
equilibrio
con
la
fase
liquida
se
conoce
como
la
presión
de
vapor.
La
presión
de
vapor
de
equilibrio
depende
no
solo
de
la
temperatura
sino
también
de
la
naturaleza
de
los
componentes
y
la
composición
en
cada
una
de
las
fases.
En
mezclas
ideales,
la
presión
de
vapor
es
proporcional
a
la
fracción
molar
de
cada
uno
de
los
componentes
acorde
con
Ley
de
Raoult.
Así
se
pueden
elaborar
diagramas
de
presión
de
vapor
en
función
de
la
composición
de
la
fase
líquida
y
la
fase
de
vapor
a
temperatura
constante;
también
es
posible
elaborar
diagramas
de
punto
de
ebullición
en
función
de
la
composición
de
la
fase
líquida
y
la
fase
de
vapor
a
temperatura
constante;
también
es
posible
elaborar
diagramas
de
punto
de
ebullición
en
función
de
la
composición
de
la
mezcla
para
presión
constante.
Experimentalmente
para
mezclas
de
dos
componentes
o
mezclas
binarias
se
ha
determinado
las
composiciones
molares
tanto
de
la
fase
gaseosa
como
de
la
fase
líquida
cuando
ellas
están
en
equilibrio,
en
función
de
la
temperatura.
Cuando
se
grafican
esos
datos
experimentales
se
tienen
los
diagramas
de
punto
de
ebullición
como
el
representado
en
la
figura
6-1
Al
tener
una
mezcla
binaria
con
los
compuesto
A
y
B,
en
el
diagrama
de
punto
de
ebullición,
Ta
representa
la
temperatura
de
ebullición
del
compuesto
A,
a
una
presión
constante
P,
en
tanto
que
el
componente
B
tiene
su
punto
de
ebullición
Tb.
Se
ha
tomado
un
compuesto
A
cuyo
punto
de
ebullición,
Figura
6-1,
consta
de
dos
curvas
que
terminan
en
puntos
iguales
Ta
o
Tb
.
La
curva
inferior
corresponde
a
la
temperatura
de
ebullición
de
la
mezcla
líquida
en
función
de
la
composición
de
la
fase
líquida
y
la
curva
superior
a
la
temperatura
de
condensación
de
la
mezcla
gaseosa
en
función
de
la
composición
de
la
fase
gaseosa
o
de
vapor.
Diagrama de fases
En termodinamica y ciencia de materiales se denomina diagrama de fase o
diagrama de estados de
la materia, a la representación entre
diferentes estados de la materia,
en función de variables elegidas para facilitar el estudio del
mismo. Cuando en una de estas representaciones todas las fases
corresponden a estados de agregación diferentes se suele denominar
diagrama de cambio de estado.
Los diagramas de equilibrio pueden tener diferentes
concentraciones de materiales que forma una aleación a distintas
temperaturas. Dichas temperaturas van desde la temperatura por encima
de la cual un material está en fase líquida hasta la temperatura
ambiente y en que generalmente los materiales están en estado
sólido.
- Un diagrama de fases muestra la relación entre la presión y la temperatura para cada una de las fases de una cierta sustancia
- Cada una de las líneas de un diagrama de fases corresponde a una condición de equilibrio donde coexisten dos fases.
- La línea correspondiente al equilibrio sólido-gas representa la presión de vapor del sólido a distintas temperaturas de sublimación
- La línea correspondiente al equilibrio sólido-líquido representa la variación en el punto de fusión del sólido cuando varía la presión.
- El punto de fusión es idéntico a su punto de congelación, lo que varía es el sentido desde el cual se alcanza el cambio de fase.
- El punto o temperatura de fusión normal es la temperatura a la cual funde un sólido a la presión de 1 atm. Es característico de cada sustancia.
- Para la mayoría de las sustancias el sólido es más denso que el líquido. En ese caso la temperatura de fusión aumenta con la presión y la línea correspondiente al equilibrio sólido-líquido tiene pendiente positiva.
- Para algunas sustancias, como el agua, el sólido es menos denso que el líquido y por eso flota. En ese caso la temperatura de fusión disminuye cuando aumenta la presión y la línea correspondiente al equilibrio sólido-líquido tiene pendiente negativa
- El punto triple es el punto del diagrama de fases donde coexisten las tres fases: sólido, líquido y gas.
- La temperatura crítica es la máxima temperatura a la cual un gas puede ser licuado. Por encima de ese valor, el gas no puede ser licuado y se llama gas propiamente dicho (no es vapor).
- La presión crítica es la presión requerida para licuar un gas a la temperatura crítica. El punto crítico corresponde a la temperatura y a la presión crítica.
- Las sustancias cuya presión en el punto triple sea superior a 1 atm, como el CO2 (hielo seco), no tienen punto de fusión normal sino punto de sublimación normal. En consecuencia cuando el sólido se calienta a 1 atm no funden sino que subliman.
Representacion grafica de las condiciones de temperatura y presion a la que existen los Solidos, Liquidos y gases como fases unicas de los estados de la materia o como dos o mas faces en equilibrio
Lineas AB ,BD y BC:
cada punto corresponde a un par de valores P,T en las que coexisten dos fases en equilibrio:
AB: equilibrio solido-gas
BD: equilibrio solido-liquido
BC: equilibrio liquido-gas
Punto triple
En este punto en la sustancia coexisten en equilibrio los tres
estados, está parcialmente solida, parcialmente líquida y
parcialmente gaseosa. Obsérvese que para valores de presión o
temperatura mas bajas que el punto triple la sustancia en cuestión
no puede existir en estado líquido y solo puede pasar desde sólido
a gaseoso en un proceso conocido como sublimación.
Punto triple del agua
Es la combinación de presión y temperatura en la que los estados
de agregación del agua; sólido, líquido y gaseoso (agua líquida,
hielo y vapor, respectivamente) pueden coexistir en un equilibrio
estable, se produce exactamente a una temperatura de 273,16 k (0,0098 C)
y a una presion parcial de vapor de agua de 611,73 pascales (6,1173 milibares;
0,0060373057 atm). En esas condiciones, es posible cambiar el
estado de toda la masa de agua a hielo, agua líquida o vapor
arbitrariamente haciendo pequeños cambios en la presión y la
temperatura. Se debe tener en cuenta que incluso si la presión total
de un sistema está muy por encima de 611,73 pascales (es decir, un
sistema con una presión atmosférica
normal), si la presión parcial del vapor de agua es 611,73 pascales,
entonces el sistema puede encontrarse aún en el punto triple del
agua. Estrictamente hablando, las superficies que separan las
distintas fases también debe ser perfectamente planas, para evitar
los efectos de las tensiones de superficie.
El agua tiene un inusual y complejo diagrama de fase
(aunque esto no afecta a las consideraciones generales expuestas
sobre el punto triple). A altas temperaturas, incrementando la
presión, primero se obtiene agua líquida y, a continuación, agua
sólida. Por encima de 109 Pa aproximadamente se obtiene una forma
cristalina de hielo que es más denso que el agua líquida. A
temperaturas más bajas en virtud de la compresión, el estado
líquido deja de aparecer y el agua pasa directamente de sólido a
gas.
A presiones constantes por encima del punto triple, calentar hielo
hace que se pase de sólido a líquido y de éste a gas (o vapor). A
presiones por debajo del punto triple, como las encontradas en el
espacio exterior, donde la presión es cercana a cero, el agua
líquida no puede existir y, al calentarse, el hielo se convierte
directamente en vapor de agua sin pasar por el estado líquido,
proceso conocido como sublimación.
La presión del punto triple del agua fue utilizada durante la
misión Mariner 9 a Marte como un punto de referencia para definir "el nivel del mar".
Misiones más recientes hacen uso de altimetría láser y gravimetría
en lugar de la presión atmosférica para medir la elevación en
Marte.
Tabla de puntos triples
En esta tabla se incluyen los puntos triples de algunas sustancias comunes. Estos datos están basados en los proporcionados por la National Bureau of Standards (ahora NIST) de los EE.UU de América.| Sustancia | T (K) | P (kPa) |
|---|---|---|
| Acetileno | 192,4 | 120 |
| Amoníaco | 195,40 | 6,076 |
| Argón | 83,81 | 68,9 |
| Grafito | 3900 | 10100 |
| Dióxido de carbono | 216,55 | 517 |
| Monóxilo de carbono | 68,10 | 15,37 |
| Deuterio | 18,63 | 17,1 |
| Etano | 89,89 | 8 × 10−4 |
| Etileno | 104,0 | 0,12 |
| Helio-4 | 2,19 | 5,1 |
| Hidrógeno | 13,84 | 7,04 |
| Cloruro de hidrógeno | 158,96 | 13,9 |
| Mercurio | 234,2 | 1,65 × 10−7 |
| Metano | 90,68 | 11,7 |
| Neón | 24,57 | 43,2 |
| Óxido nítrico | 109,50 | 21,92 |
| Nitrógeno | 63,18 | 12,6 |
| Óxido nitroso | 182,34 | 87,85 |
| Oxígeno | 54,36 | 0,152 |
| Paladio | 1825 | 3,5 × 10−3 |
| Platino | 2045 | 2,0 × 10−4 |
| Dióxido de azufre | 197,69 | 1,67 |
| Titanio | 1941 | 5,3 × 10−3 |
| Hexafluoruro de uranio | 337,17 | 151,7 |
| Agua | 273,16 | 0,61 |
| Xenón | 161,3 | 81,5 |
| Zinc | 692,65 | 0,065 |
Autores:
Lizneidy Fernandez CI: 25.966.474
Andreina Brizuela CI: 24.813.424
Zulimar Pérez CI: 24.684.884
Manuel Rodriguez CI: 24.814.573
II Agroindustrial "C"




The rules of Baccarat - FABBASINO.COM
ResponderBorrarWhat rules 카지노사이트 do you use to play งานออนไลน์ online? · Blackjack · Keno · 바카라 Craps · Blackjack · Keno · Keno · What are the rules of Baccarat? · Keno · Craps · Blackjack.
Slots & Video Poker - JT Hub
ResponderBorrarSlots 삼척 출장샵 & Video Poker. 고양 출장마사지 We provide 군산 출장안마 top-notch 정읍 출장샵 slots, video poker games, video poker 여수 출장마사지 and table games for your device. We offer the largest selection of gaming